首经贸刚刚发布校歌?来,听一堂名校校歌赏析课!
Аминокиселини — основните единици од кои се изградени белковините. Тие се аминодеривати на карбоксилните киселини и имаат општа формула:

Од формулата се забележува дека секо?а аминокиселина покра? остатокот R, содржи на?малку две функционални групи - една амино (лево) и една карбоксилна (десно) група. Фенилаланинот е една од стандардните аминокиселини:

Со оглед на структурата на аминокиселините, ги делиме на:
- моноаминокарбонски
- диаминокарбонски
- аминодикарбонски
- ароматски
- хетероциклични
Аминокиселините се структурни елементи на белковините во кои се поврзани со пептидна врска.
—NH—CO—.
Играат огромна улога во процесите на метаболизмот ка? сите живи организми.
На?едноставна аминокиселина е глицин: H2N—CH2—COOH.
Во структурата на аминокиселините, аминогрупата во однос на карбоксилната група може да се нао?а во различни положби. Во зависност од таа положба се разликуваат α, β, γ, δ итн. аминокиселини.
α-аминокиселини
[уреди | уреди извор]
Сите пептиди и полипептиди (белковини) се полимери на α-аминокиселините. Посто?ат 20 α-аминокиселини кои се составен дел на белковините ка? цицачите. Неколку други видови на аминокиселини се нао?аат во телото како слободни соединени?а или во комбинирана состо?ба (т.е. не се асоцирани со пептиди или белковини). Овие небелковински асоцирани аминокиселини имаат специ?ализирани функции. Еден дел од аминокиселините кои се составен дел на белковините исто така извршуваат и некои други функции, различни од образува?ето на пептидите и белковините. На пример, тирозинот учествува во образува?ето на тироидните хормони или, пак, глутаматот ко? де?ствува како невротрансмитер.
α-аминокиселините во пептидите и белковините (со исклучок на пролинот) се состо?ат од карбоксилна киселина, односно група (-COOH) и амино (-NH2) функционална група сврзани за истиот тетраедарски ?аглероден атом. Ово? атом се означува како α-?аглероден атом (оттука и α-аминокиселини). Одделни R-групи, со кои една аминокиселина се разликува од друга, се исто така сврзани за α-?аглеродот (со исклучок на глицинот, каде R-групата е водород). Четвртиот супституент прикачен за тетраедарскиот α-?аглерод ка? аминокиселините е водородот.
Список на аминокиселини
[уреди | уреди извор]| Аминокиселина | Со 3 букви | Со 1 буква | Поларност | Киселост или базност |
|---|---|---|---|---|
| аланин | ala | A | неполарна | неутрална |
| аргинин | arg | R | поларна | силно базна |
| аспарагин | asn | N | поларна | неутрална |
| аспарагинска киселина | asp | D | поларна | кисела |
| аспарагин или аспартичка киселина* | asx | B | ||
| цистеин | cys | C | неполарна | неутрална |
| глутамат | glu | E | поларна | кисела |
| глутамин | gln | Q | поларна | неутрална |
| глутамин или глутамска киселина* | glx | Z | ||
| глицин | gly | G | неполарна | неутрална |
| хистидин | his | H | поларна | слабо базна |
| изолеуцин | ile | I | неполарна | неутрална |
| леуцин | leu | L | неполарна | неутрална |
| лизин | lys | K | поларна | базна |
| метионин | met | M | неполарна | неутрална |
| фенилаланин | phe | F | неполарна | неутрална |
| пролин | pro | P | неполарна | неутрална |
| серин | ser | S | поларна | неутрална |
| треонин | thr | T | поларна | неутрална |
| триптофан | trp | W | неполарна | неутрална |
| тирозин | tyr | Y | поларна | неутрална |
| валин | val | V | неполарна | неутрална |
Класификаци?а на α-аминокиселините
[уреди | уреди извор]Секо?а од дваесетте α-аминокиселини на?дени во белковините можат да се разликуваат по R-групата (R-супституентот) на α-?аглеродот. Посто?ат две големи класи на аминокиселини чи?а поделба се основа на тоа дали R-групата е хидрофобна или хидрофилна.
Хидрофобните аминокиселини неможат да опсто?ат во водна средина и затоа на?многу се нао?аат во внатрешноста на белковините. Оваа класа на аминокиселини не ?онизира, ниту пак учествува во образува?ето на водородни врски. Хидрофилните аминокиселини стапуваат во заемоде?ства со водната средина и често учествуваат во образува?ето на водородни врски. Тие на?често се нао?аат на надворешните површини на белковинитеили во реактивните центри на ензимите.
Киселинско-базни сво?ства на аминокиселините
[уреди | уреди извор]α-СООН и α-NH2 групите во аминокиселините се способни за ?онизаци?а (како што се и киселите и базни R-групи). Како резултат на нивната ?онизациона способност, можат да се напишат следните реакции на ?онска рамнотежа:
- и
Рамнотежните реакции, како што се напишани, покажуваат дека аминокиселините содржат барем две послаби кисели групи. Но, карбоксилната група е далеку посилна киселина отколку аминогрупата. При физиолошка pH-вредност (околу 7,4), карбоксилната група ?е биде депротонирана и аминогрупата ?е се протонира (?е прими протон). Аминокиселина со R-група ко?а не е способна за ?онизаци?а ?е биде електронеутрална при оваа pH-вредност. Ваквиот комплекс се нарекува цвитер?он.
Како и типичните органски киселини, киселинската сила на карбоксилната, амино и ?онизационо способните R-групи во аминокиселините можат да се дефинираат со константата на асоци?аци?а Ka, или поконкретно негативниот логаритам на Ka, pKa. Вкупниот полнеж (алгебарскиот збир на сите присутни наелектризирани групи) на било ко?а аминокиселина, пептид или белковина, ?е зависи од pH на околната водна средина. Како што се менува pH на растворот од аминокиселини или белковини, така се менува и вкупниот полнеж. Ово? феномен може да се наб?удува за време на титраци?ата на секо?а аминокиселина или белковина. Кога вкупниот полнеж на една аминокиселина или белковина е нула, тогаш pH ?е биде еднаква на изоелектричната точка (pI).
Функционално значе?е на R-групите од аминокиселините
[уреди | уреди извор]Во раствор, сосема типично е што R-групите од аминокиселините ?а диктираат структурно-функционалната поврзаност на пептиидте и белковините. Хидрофобните аминокиселини главно ?е се соберат во внатрешноста на белковините, заштитени од директниот контакт со водата. Обратно, хидрофилните аминокиселини главно се нао?аат во надворешноста на белковините, како и во активните центри на ензимски активните белковини. Всушност, некои ензимски реакции се случуваат токму како резултат на присуството на R-групите.
Имидазолниот прстен на хистидинот овозможува то? да де?ствува и како протон-дарител, и како протон-акцептор при физиолошка pH-вредност. Значи, то? често се нао?а во реактивните центри на ензимите. Еднакво важна е и можноста на хистидинот во хемоглобинот да ги оттргнува H+ ?оните при ?онизаци?ата на ?аглеродната киселина во еритроцитите. Токму како резултат на ова, хемоглобинот врши размена на гасови во ткивата и белите дробови.
Првичниот алкохол на серинот и треонинот, како и тиолот (-SH) на цистеинот им дозволуваат на овие аминокиселини да де?ствуваат како нуклеофили за време на катализата. Додатно, тиолот од цистеинот е способен да образува дисулфидна врска со други цистеини:
Ово? прост дисулфид е означен како цистин. Образува?ето на дисулфидни врски поме?у цистеините присутни во белковините е важно за образува?ето на активни структурни домени ка? голем бро? на белковини. Дисулфидното поврзува?е поме?у цистеините во различни полипептидни ланци на олигомерни белковини игра знача?на улога во уредува?ето на структурата на комплексните белковини, како на пример, инсулинските рецептори.
Оптички сво?ства на аминокиселините
[уреди | уреди извор]
Тетраедарскиот ?аглероден атом за ко? се сврзани 4 различни супституенти се нарекува хирален C-атом. Единствената аминокиселина ка? ко?а не се сре?ава хиралност е глицинот, биде??и неговата "R-група" е водороден атом. Хиралноста ?а опишува способноста на дадена молекула да ?а врти рамнината на поларизираната светлина на десно (декстроротаторно) или, пак, на лево (леворотаторно). Сите белковински аминокиселини ?а даваат истата апсолутна стеричка конфигураци?а како ?аглехидратот L-глицералдехид. Поради тоа тие се L-α-аминокиселини. D-α-аминокиселини не се на?дени никогаш во белковините, иако посто?ат во природата. D-аминокиселините на?често се нао?аат во полипептидните антибиотици.
Ароматичните R-групи во аминокиселините апсорбираат ултравиолетова светлина со апсорпциски максимум од 280 nm. Можноста на белковините да ?а апсорбираат ултравиолетовата светлина е главно резултат на присуството на триптофанот ко? силно ?а апсорбира истата.
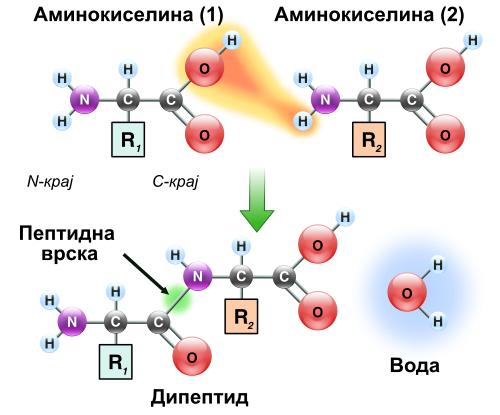
Пептидна врска
[уреди | уреди извор]Образува?ето на пептидна врска е реакци?а на кондензаци?а ко?а доведува до полимеризаци?а на аминокиселините во пептиди и белковини. Пептидите се мали и се состо?ат од неколку аминокиселини. Некои хормони и невротрансмитери се пептиди. Исто така, неколку антибиотици и антитуморни агенси се пептиди. Белковините се полипептиди со голема молекулска маса. На?простиот пептид (дипептид) се состои од една пептидна врска ко?а се образува со кондензаци?а на карбоксилната група на една аминокиселина со аминогрупата на втората аминокиселина, притоа одделува??и една молекула на вода. Присуството на карбонилната група во пептидната врска овозможува електронско-резонантна стабилизаци?а, таква што не дозволува слободна ротаци?а околу самата пептидна врска, што е нетипично за другите дво?ни врски -C=C-. Се вели дека пептидната (или амидна) врска има делумен двоен карактер.
| ||||||||||||||||||||||||||||||
|




